कक्षा 9 विज्ञान पाठ 4 परमाणु की संरचना एनसीईआरटी अभ्यास के प्रश्न उत्तर सरल भाषा में दिया गया है। इन एनसीईआरटी समाधान के माध्यम से छात्र परीक्षा की तैयारी बेहतर तरीके से कर सकते हैं। जिससे छात्र कक्षा 9 विज्ञान परीक्षा में अच्छे अंक प्राप्त कर सकते हैं। छात्रों के लिए कक्षा 9 विज्ञान के प्रश्न उत्तर एनसीईआरटी किताब के अनुसार बनाये गए है। कक्षा 9 हिंदी मीडियम के छात्रों की मदद करने के लिए, हमने एनसीईआरटी समाधान से संबंधित सभी सामग्रियों को नए सिलेबस के अनुसार संशोधित किया है। विद्यार्थी ncert solutions for class 9 science chapter 4 hindi medium को यहाँ से निशुल्क में प्राप्त कर सकते हैं।
एनसीईआरटी समाधान कक्षा 9 विज्ञान अध्याय 4 परमाणु की संरचना
पृष्ठ संख्या 43
1. केनाल किरणें क्या हैं?
उत्तर: केनाल किरणें धनावेशित विकिरण हैं जो एनोड से कैथोड की ओर चलती हैं। इन्हें एनोड किरणें भी कहते हैं। केनाल किरणों के कारण ही धन आवेशित अवपरमाणुक कण प्रोटॉन की खोज हुई।
2. यदि किसी परमाणु में एक इलेक्ट्रॉन और एक प्रोटॉन है, तो इसमें कोई आवेश होगा या नहीं?
उत्तर: हम जानते हैं कि प्रत्येक इलेक्ट्रॉन पर 1 इकाई ऋण आवेश और प्रत्येक प्रोटॉन पर 1 इकाई धन आवेश होता है। इसलिए आवेश की संख्या समान परंतु विपरीत होने के कारण परमाणु पर कोई आवेश नहीं होता और वे उदासीन होते हैं।
पृष्ठ संख्या 46
1. परमाणु उदासीन है, इस तथ्य को टॉमसन के मॉडल के आधार पर स्पष्ट कीजिए।
उत्तर: टॉमसन मॉडल के अनुसारः
(i) परमाणु धन आवेशित गोले का बना होता है। और इलेक्ट्रॉन उसमें फँसे होते हैं।
(ii) ऋणात्मक और धनात्मक आवेश परिमाण में समान होते हैं। इसलिए परमाणु वैद्युतीय रूप से उदासीन होते हैं।
2. रदरफ़ोर्ड के परमाणु मॉडल के अनुसार, परमाणु के नाभिक में कौन-सा अवपरमाणुक कण विद्यमान है?
उत्तर: रदरफ़ोर्ड के परमाणु मॉडल के अनुसार परमाणु का केंद्र धनावेशित होता है, जिसे नाभिक कहा जाता है। इसलिए नाभिक में अवपरमाणुक कण प्रोटॉन विद्यमान होते हैं क्योंकि प्रोटॉन धनावेशित होता है।
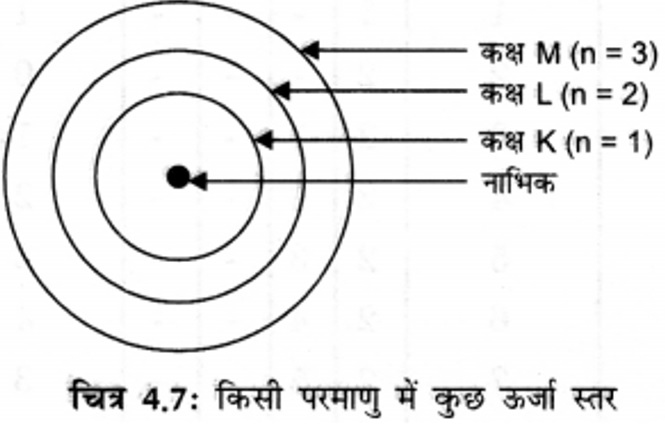
3. तीन कक्षाओं वाले बोर के परमाणु मॉडल का चित्र बनाइए।
उत्तर:
4. क्या अल्फा कणों का प्रकीर्णन प्रयोग सोने के अतिरिक्त दूसरी धातु की पन्नी से संभव होगा?
उत्तर: हाँ, 7-कणों का प्रकीर्णन किसी भी धातु की पन्नी से संभव है और परिणाम वही प्राप्त होगा क्योंकि सभी धातुओं के परमाणुओं की संरचना एक जैसी होती है।
पृष्ठ संख्या 46
1. परमाणु के तीन अवपरमाणुक कणों के नाम लिखें।
उत्तर: परमाणु के तीन अवपरमाणुक कणों के नाम हैं
(i) इलेक्ट्रॉन
(ii) प्रोटॉन
(iii) न्यूट्रॉन
2. हीलियम परमाणु का परमाणु द्रव्यमान 4u है और उसके नाभिक में दो प्रोटॉन होते हैं। इसमें कितने न्यूट्रॉन होंगे?
उत्तर: हीलियम (He) का परमाणु द्रव्यमान = 4u
परमाणु द्रव्यमान = न्यूट्रॉन की संख्या + प्रोटॉन की संख्या
⇒ 4 = न्यूट्रॉन की संख्या + 2
⇒ न्यूट्रॉन की संख्या = 4 – 2
⇒ न्यूट्रॉन की संख्या = 2
अत: हीलियम परमाणु में न्यूट्रॉनों की संख्या = 2 है।
पृष्ठ संख्या 47
1. कार्बन और सोडियम के परमाणुओं के लिए इलेक्ट्रॉन-वितरण लिखिए।
उत्तर: कार्बन के परमाणु में इलेक्ट्रॉनों की संख्या = 6
इलेक्ट्रॉन-वितरण
| कक्ष | इलेक्ट्रॉन की संख्या |
| K | 2 |
| L | 4 |
सोडियम के परमाणु में इलेक्ट्रॉनों की संख्या = 11
इलेक्ट्रॉन-वितरण
| कक्ष | इलेक्ट्रॉन की संख्या |
| K | 2 |
| L | 8 |
| M | 1 |
2. अगर किसी परमाणु का K और L कोश भरा है तो उस परमाणु में इलेक्ट्रॉनों की संख्या क्या होगी?
उत्तर: K कोश में अधिकतम 2 तथा L कोश में अधिकतम 8 इलेक्ट्रॉन रह सकते हैं। चूंकि ये दोनों कोश भरे हैं।
इसलिए इस परमाणु में इलेक्ट्रानों की कुल संख्या = 2 + 8 = 10 होगी।
पृष्ठ संख्या 48
1. क्लोरीन, सल्फर और मैग्नीशियम की परमाणु संख्या से आप इसकी संयोजकता कैसे प्राप्त करेंगे?
उत्तर: हम जानते हैं कि परमाणु के बाह्यतम कक्ष में अष्टक बनाने के लिए जितनी संख्या में इलेक्ट्रॉनों की साझेदारी या स्थानांतरण होता है, वही उस तत्त्व की संयोजकता-शक्ति अर्थात् संयोजकता होती है।
(i) क्लोरीन, परमाणु संख्या = 17
प्रोटॉन = 17, इलेक्ट्रॉन = 17
इलेक्ट्रॉनों का वितरणः
K L M
2 8 7
चूँकि Cl के बाह्यतम कोश में 7 इलेक्ट्रॉन हैं। इसलिए अष्टक पूर्ण करने के लिए 1 इलेक्ट्रॉन ग्रहण करेगा ताकि निकटतम अक्रिय गैस इलेक्ट्रॉनिक विन्यास प्राप्त कर सके।
Cl की संयोजकता = 8 – 7 = 1 है।
(ii) सल्फर परमाणु संख्या = 16
इलेक्ट्रॉन 16, प्रोटॉन = 16
इलेक्ट्रॉनों का वितरणः
K L M
2 8 6
सल्फर को अष्टक पूर्ण करने के लिए 2 इलेक्ट्रॉनों की आवश्यकता है। सल्फर 2 इलेक्ट्रॉन ग्रहण कर अष्टक पूर्ण करेगा।
इसलिए सल्फर की संयोजकता = 8 – 6 = 2
(iii) मैग्नीशियम, परमाणु संख्या = 12
इलेक्ट्रॉनों की संख्या = 12 प्रोटॉनों की संख्या = 12
इलेक्ट्रॉनों का वितरणः
K L M
2 8 2
चूँकि बाह्यतम कोश में इलेक्ट्रॉनों की संख्या 2 है, इसलिए मैग्नीशियम 2 इलेक्ट्रॉनों का परित्याग कर अष्टक पूर्ण करेंगे।
मैग्नीशियम की संयोजकता = 2 है।
पृष्ठ संख्या 49
1. यदि किसी परमाणु में इलेक्ट्रॉनों की संख्या 8 है और प्रोटॉनों की संख्या भी 8 है तब,
(a) परमाणु की परमाणुक संख्या क्या है?
(b) परमाणुक का क्या आवेश है?
उत्तर:
(a) प्रोटॉनों की संख्या = 8
परमाणु संख्या = प्रोटॉनों की संख्या = 8
(b) प्रोटॉनों की संख्या = 8
इलेक्ट्रॉनों की संख्या = 8
चूँकि प्रत्येक प्रोटॉन का आवेश (+1) और प्रत्येक इलेक्ट्रॉन का आवेश (-1) होता है।
कुल आवेश =(+ 8)+(-8) = 0
अतः परमाणु पर कोई आवेश नहीं है। यह उदासीन है।
2. सारणी 4.1 की सहायता से ऑक्सीजन और सल्फर-परमाणु की द्रव्यमान संख्या ज्ञात कीजिए।
उत्तर: एक परमाणु के नाभिक में उपस्थित प्रोटॉनों और न्यूट्रॉनों की संख्या के योग को द्रव्यमान संख्या कहा जाता है।
अर्थात द्रव्यमान संख्या = प्रोटॉन की संख्या + न्यूट्रॉन की संख्या
ऑक्सीजनः प्रोटॉन = 8, न्यूट्रॉन = 8 द्रव्यमान संख्या = 8 + 8 = 16 u
सल्फरः प्रोटॉन = 16, न्यूट्रॉन = 16
द्रव्यमान संख्या = 16 + 16 = 32 u
पृष्ठ संख्या 50
1. चिन H, D और T के लिए प्रत्येक में पाए जाने वाले तीन अवपरमाणुक कणों को सारणीबद्ध कीजिए।

2. समस्थानिक और समभारिक के किसी एक युग्म का इलेक्ट्रॉनिक विन्यास लिखिए।
उत्तर: समस्थानिक: किसी एक ही तत्व के परमाणु जिनकी परमाणु संख्या तो समान है। लेकिन द्रव्यमान संख्या भिन्न-भिन्न होती है, उन्हें समस्थानिक कहलाते हैं। जैसे: कार्बन, 12C, 14C
| K | L | |
| 12C-6 | 2 | 4 |
| 14C-6 | 2 | 4 |
समभारिक: अलग-अलग तत्वों के परमाणु जिनकी द्रव्यमान संख्या तो समान होती है। लेकिन परमाणु संख्या भिन्न-भिन्न होती है, समभारिक कहलातें हैं। जैसे: 40Ca-20, 40Ar-16
| K | L | M | N | |
| 40Ca-20 | 2 | 8 | 8 | 2 |
| 40Ar-16 | 2 | 8 | 8 |
पाठ्यपुस्तक से हल प्रश्न
1. इलेक्ट्रॉन, प्रोटॉन और न्यूट्रॉन के गुणों की तुलना कीजिए।
उत्तर:
| गुण | इलेक्ट्रॉन | प्रोटॉन | न्यूट्रॉन |
| संकेत | e – | p+ | n |
| आवेश | -1 | +1 | 0 |
| द्रव्यमान | 9.109 × kg | 1.673 × kg | 1.675 × kg |
| एब्सोल्यूट आवेश | – 1.6 × | 1.6 × | 0 |
2. जे.जे. टॉमसन के परमाणु मॉडल की क्या सीमाएँ हैं?
उत्तर: जे.जे. टॉमसन के मॉडल से परमाणु के उदासीन होने की व्याख्या हुई, परंतु दूसरे वैज्ञानिकों द्वारा किए गए प्रयोगों के परिणामों को इस मॉडल के द्वारा समझाया नहीं जा सका।
जैसे – रदरफ़ोर्ड के α – कण प्रकीर्णन प्रयोग में ज्यादातर अल्फा-कण सीधे क्यों निकल गए, कुछ अल्फा-कण बहुत छोटे कोण से क्यों विक्षेपित हुए और बहुत कम कण वापस क्यों आ गए? इन प्रश्नों की व्याख्या करने में यह मॉडल असफल रहा।
अथवा
जे. जे. टॉमसन के परमाणु मॉडल की निम्नलिखित सीमाएँ हैं:
- जे. जे. टॉमसन के परमाणु मॉडल इलेक्ट्रॉन की अवस्था को सही तरीके से नहीं बता पाया था।
- यह मॉडल परमाणु के केन्द्र कभी पता लगाने में असमर्थ था।
- जे. जे. टॉमसन के परमाणु मॉडल में केवल परमाणु के उदासीन होने की ब्याख्या की गई किंतु दूसरे वैज्ञानिकों द्वारा किये गये प्रयोगों में इसे नहीं समझाया जा सका।
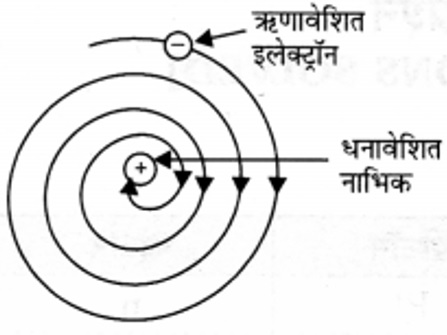
3. रदरफ़ोर्ड परमाणु मॉडल की क्या सीमाएँ हैं?
उत्तर: यदि कोई भी आवेशित कण गोलाकार कक्ष में त्वरित
होगा तो आवेशित कणों से ऊर्जा का विकिरण होगा, जिससे इसकी ऊर्जा निरंतर घटती जाएगी और इसकी गति भी कम होती जाएगी। अंततः स्थायी कक्ष में घूमता हुआ इलेक्ट्रॉन एक सर्पिल (Spiral) पथ का निर्माण कर नाभिक से टकरा जाएगा। अगर ऐसा होता, तो परमाणु अस्थिर होता जबकि हम जानते हैं। कि परमाणु स्थायी होते हैं। परमाणु समाप्त या नष्ट नहीं होते।
अतः रदरफ़ोर्ड का परमाणु मॉडल परमाणु के स्थायित्व की व्याख्या कर पाने में असफल रहा।
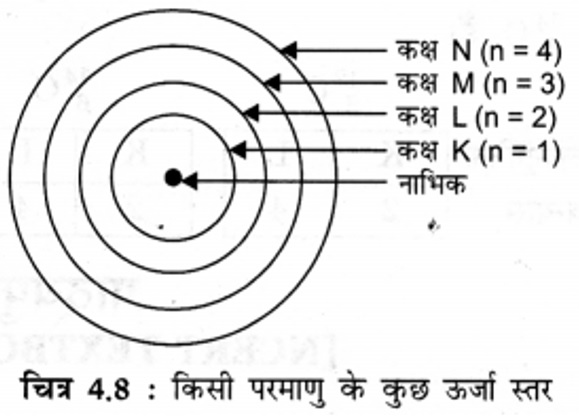
4. बोर के परमाणु मॉडल की व्याख्या कीजिए।
उत्तर: नील्स बोर ने परमाणु की संरचना के बारे में निम्नलिखित अवधारणाएँ प्रस्तुत कीं|
(i) परमाणु के केंद्र में एक धनावेशित नाभिक होता है। प्रोटॉन और न्यूट्रॉन नाभिक में होते हैं।
(ii) इलेक्ट्रॉन केवल कुछ निश्चित कक्षाओं में ही चक्कर लगा सकते हैं, जिन्हें इलेक्ट्रॉन की विविक्त कक्षा (Discrete Orbits) कहते हैं।
(iii) जब इलेक्ट्रॉन इस विविक्त कक्षा में चक्कर लगाते हैं, तो उनकी ऊर्जा का विकिरण नहीं होता।
इन कक्षाओं (या कोशों) को ऊर्जा-स्तर कहते हैं, जिन्हें K, L, M, N…….. या संख्याओं 1, 2, 3, 4, ……. के द्वारा दिखाया जाता है।
5. इस अध्याय में दिए गए सभी परमाणु मॉडलों की तुलना कीजिए।
उत्तर:

अथवा
जे.जे. टॉमसन का परमान मॉडल:
- परमाणु एक धन आवेशित गोला होता है और इलेक्ट्रॉन इसकी सतह पर धंसे होते हैं
- किसी भी परमाणु में इलेक्ट्रॉनों की संख्या और प्रोटोनों की संख्या के बराबर होती है। जिसके कारण ऋणात्मक और धनात्मक आवेश परिमाण में समान होते हैं। इसलिए परमाणु विद्युत के रूप से उदासीन होते हैं।
रदरफोर्ड का परमाणु मॉडल:
- परमाणु का केंद्र धन आवेशित होता है जिसे नाभिक कहा जाता है।
- परमाणु का लगभग संपूर्ण द्रव्यमान नाभिक में होता है।
- इलेक्ट्रॉन नाभिक के चारो और निश्चित कक्षाओं में वर्तुलाकार मार्ग से चक्कर लगाते हैं।
- नाभिक का आकार परमाणु के आकार की तुलना में काफी छोटा होता है।
नील्स बोर का परमाणु मॉडल:
- इलेक्ट्रॉन केवल कुछ निश्चित कक्षाओं में ही चक्कर लगा सकते हैं। जिन्हें इलेक्ट्रॉन की विशेष कक्षा कहा जाता है।
- जब इलेक्ट्रॉन इन विवीक्त कक्षा में चक्कर लगाते हैं तो उसकी ऊर्जा का विकिरण नहीं होती है।
- ये कक्षाएं है K, L, M, N, ………
6. पहले अठारह तत्त्वों के विभिन्न कक्षों में इलेक्ट्रॉन वितरण के नियम को लिखिए।
उत्तर: परमाणुओं की विभिन्न कक्षाओं में इलेक्ट्रॉनों के वितरण के लिए बोर और बरी ने निम्नलिखित नियम प्रस्तुत किए।
(i) किसी कक्षा में उपस्थित अधिकतम इलेक्ट्रॉनों की संख्या 2n2 से दर्शाया जाता है; जहाँ ‘n’ कक्षा की संख्या या ऊर्जा स्तर है।
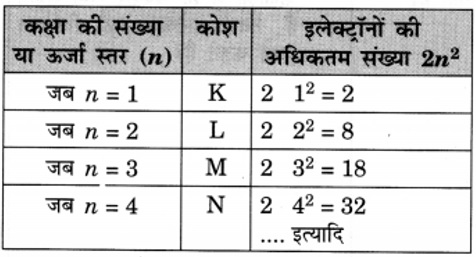
(ii) सबसे बाहरी कोश में इलेक्ट्रॉनों की अधिकतम संख्या 8 हो सकती है।
(iii) किसी परमाणु के दिए गए कोश में इलेक्ट्रॉन तब तक स्थान नहीं लेते हैं जब तक कि उससे पहले वाले भीतरी कक्ष पूर्णरूप से भर नहीं जाते। इससे स्पष्ट होता है कि कक्षाएँ क्रमानुसार भरती हैं।
7. सिलिकॉन और ऑक्सीजन का उदाहरण लेते हुए संयोजकता की परिभाषा दीजिए।
उत्तर: परमाणु के अष्टक बनाने के लिए जितने इलेक्ट्रॉन के स्थानांतरण या साझा करने की जरूरत होती है वही उस तत्व की संयोजकता कहलाती है। उदाहरण: Si(14) = 2, 8, 4
सिलिकॉन की बाहरी कक्षा में 4 इलेक्ट्रॉन हैं यानि यह 4 इलेक्ट्रॉन ले सकता है या दे सकता है या साझा कर सकता है। इसलिए सिलिकॉन की संयोजकता = 4। उदाहरण: O(8) = 2, 6
ऑक्सीजन की बाहरी कक्षा में 6 इलेक्ट्रॉन हैं यानि यह 2 इलेक्ट्रॉन ले सकता है या 6 इलेक्ट्रॉन दे सकता है। 6 इलेक्ट्रॉन दान करने की तुलना में 2 इलेक्ट्रॉन लेना अधिक आसान है। इसलिए ऑक्सीजन की संयोजकता = 2
8. उदाहरण के साथ व्याख्या कीजिए-परमाणु संख्या, द्रव्यमान संख्या, समस्थानिक और समभारिक। समस्थानिकों के कोई दो उपयोग लिखिए।
उत्तर: परमाणु संख्या (Atomic Number) – एक तत्त्व की परमाणु संख्या नाभिक (केंद्रक) में विद्यमान प्रोटॉनों की कुल संख्या के बराबर होती है। इसे Z के द्वारा दर्शाया जाता है। हाइड्रोजन के लिए Z = 1 क्योंकि हाइड्रोजन परमाणु के नाभिक में केवल एक प्रोटॉन होता है। इसी प्रकार, सोडियम की परमाणु संख्या Z = 11 है।
द्रव्यमान संख्या (Mass Number) – एक परमाणु के नाभिक में उपस्थित प्रोटॉनों और न्यूट्रॉनों की कुल संख्या के योग को द्रव्यमान संख्या कहा जाता है। उदाहरण के लिए, कार्बन का द्रव्यमान संख्या 12u है। क्योंकि इसमें 6 प्रोटॉन और 6 न्यूट्रॉन होते हैं, 6u + 6u = 12u.
इसी प्रकार, फॉस्फोरस की द्रव्यमान संख्या = 31u है।
क्योंकि
प्रोटॉनों की संख्या = 15,
न्यूट्रॉनों की संख्या = 16
द्रव्यमान संख्या = 15 + 16 = 31
समस्थानिक (Isotopes) – एक ही तत्त्व के परमाणु जिनकी परमाणु संख्या समान लेकिन द्रव्यमान संख्या भिन्न होती हैं, समस्थानिक कहलाते हैं।
जैसे-हाइड्रोजन के तीन समस्थानिक हैं- प्रोटियम (1H1), ड्यूटीरियम (2H1 या D), ट्राइटियम ( 3H1 या T), प्रत्येक की परमाणु संख्या 1 है परंतु द्रव्यमान संख्या क्रमशः 1, 2, 3 है। इसी प्रकार कार्बन के दो समस्थानिक हैं- (12H6) और (14H6)
समभारिक (Isobars) – समभारिक विभिन्न तत्त्वों के वे परमाणु हैं, जिनकी द्रव्यमान संख्या समान लेकिन परमाणु संख्या भिन्न-भिन्न होती है। उदाहरण के लिए, कैल्सियम Ca और आर्गन की परमाणु संख्या क्रमशः 20 और 18 है परंतु दोनों तत्त्वों की द्रव्यमान संख्या 40 है। इसलिए,(40C20) और (40Ar18) समभारिक हैं।
समस्थानिकों के दो उपयोग निम्नलिखित हैं|
(i) कैंसर के उपचार में कोबाल्ट के समस्थानिक का उपयोग होता है।
(ii) यूरेनियम के एक समस्थानिक का उपयोग परमाणु भट्टी (Atomic Reactor) में ईंधन के रूप में होता है।
9. Na+ के पूरी तरह से भरे हुए K व L कोश होते हैं-व्याख्या कीजिए।
उत्तर: सोडियम Na की परमाणु संख्या = 11 इलेक्ट्रॉनिक विन्यासः
K L M
2 8 1
चूँकि सोडियम के बाह्यतम कक्ष (कोश) में 1 इलेक्ट्रॉन है इसलिए यह एक इलेक्ट्रॉन का त्याग करके (Na’) आयन बनाता है और अपना अष्टक पूर्ण करता है।
Na+ में 10 इलेक्ट्रॉन होते हैं यानी K कोश में 2 तथा L कोश में 8 हम जानते हैं कि K कोश में अधिकतम = 2 × 1² = 2 तथा L कोश में अधिकतम = 2 × 2² = 8 इलेक्ट्रॉन रह सकते हैं।
अत: Na+ में K और L कोश पूर्णतः भरे हुए हैं।
10. अगर ब्रोमीन परमाणु दो समस्थानिकों [(79Br35) (49.7%)] तथा [(81Br35) (50.3%)] के रूप में है, तो ब्रोमीन परमाणु के औसत परमाणु द्रव्यमान की गणना कीजिए।
उत्तर:

11. एक तत्त्व X का परमाणु द्रव्यमान 16.2u है तो इसके किसी एक नमूने में समस्थानिक(16X8) और(18X8) का प्रतिशत क्या होगा?

12. यदि तत्त्व को Z = 3 हो तो तत्त्व की संयोजकता क्या होगी? तत्त्व का नाम भी लिखिए।
उत्तर: परमाणु संख्या प्रतीक = Z,
अतः, परमाणु संख्या = 3
इलेक्ट्रॉनिक विन्यास = 2, 1
इसलिए, संयोजकता = 1
अतः, तत्व का नाम लिथियम Li है।
13. दो परमाणु स्पीशीज़ के केंद्रकों का संघटन नीचे दिया गया है।
| X | Y | |
| प्रोटॉन | 6 | 6 |
| न्यूट्रॉन | 6 | 8 |
X और Y की द्रव्यमान संख्या ज्ञात कीजिए। इन दोनों स्पीशीज़ में क्या संबंध है?
उत्तर: द्रव्यमान संख्या = (प्रोटॉनों की संख्या + न्यूट्रॉनों की संख्या)
अतः X का परमाणु द्रव्यमान = 6 + 6 = 12
X की परमाणु संख्या = प्रोटॉनों की संख्या = 6
Y को द्रव्यमान संख्या = 6 + 8 = 14
Y की परमाणु संख्या = प्रोटॉनों की संख्या = 6
चूँकि दो परमाणु स्पीशीज़ X और Y की परमाणु संख्या 6 समान है परंतु उनकी द्रव्यमान संख्या अलग-अलग 12 और 14 है।
अत: ये दोनों एक दूसरे के समस्थानिक हैं अर्थात कार्बन के समस्थानिक (12H6) और (14H6) हैं।
14. निम्नलिखित वक्तव्यों में गलत के लिए F और सही के लिए T लिखें
(a) जे.जे. टॉमसन ने यह प्रस्तावित किया था कि परमाणु के केंद्रक में केवल न्यूक्लीयॉन्स होते हैं।
(b) एक इलेक्ट्रॉन और प्रोटॉन मिलकर न्यूट्रॉन का निर्माण करते हैं। इसलिए यह अनावेशित होता है।
(c) इलेक्ट्रॉन का द्रव्यमान प्रोटॉन से लगभग 1/2000 गुणा होता है।
(d) आयोडीन के समस्थानिक का इस्तेमाल टिंक्चर आयोडीन बनाने में होता है। इसका उपयोग दवा के रूप में होता है।
उत्तर:
(d) F
(b) F
(c) T
(d) F
प्रश्न संख्या 15, 16 और 17 में सही के सामने (✓) का चिह्न और गलत के सामने (✗) का चिह्न लगाइए।
15. रदरफोर्ड का अल्फा कण प्रकीर्णन प्रयोग किसकी खोज के लिए उत्तरदायी था?
(a) परमाणुक केंद्रक
(b) इलेक्ट्रॉन
(c) प्रोटॉन
(d) न्यूट्रॉन
उत्तर: (a) परमाणुक केंद्रक
16. एक तत्त्व के समस्थानिक में होते हैं
(a) समान भौतिक गुण
(b) भिन्न रासायनिक गुण
(c) न्यूट्रॉनों की अलग-अलग संख्या
(d) भिन्न परमाणु संख्या
उत्तर: (c) न्यूट्रॉनों की अलग-अलग संख्या
17. Cl – आयन में संयोजकता-इलेक्ट्रॉनों की संख्या है
(a) 16
(b) 8
(c) 17
(d) 18
उत्तर: (b) 8
18. सोडियम का सही इलेक्ट्रॉनिक विन्यास निम्न में कौन सा है?
(a) 2, 8
(b) 8, 2, 1
(c) 2, 1, 8
(d) 2, 8, 1
उत्तर: (d) 2, 8, 1
19. निम्न सारणी को पूरा कीजिए-
| परमाणु संख्या | द्रव्यमान संख्या | न्यूट्रोनों की संख्या | प्रोटोनों की संख्या | इलेक्ट्रोनों की संख्या | परमाणु स्पीशीज |
| 9 | – | 10 | – | – | – |
| 16 | 32 | – | – | – | सल्फर |
| – | 24 | – | 12 | – | – |
| – | 2 | – | 1 | – | – |
| – | 1 | 0 | 1 | 0 | – |
उत्तर:
| परमाणु संख्या | द्रव्यमान संख्या | न्यूट्रोनों की संख्या | प्रोटोनों की संख्या | इलेक्ट्रोनों की संख्या | परमाणु स्पीशीज |
| 9 | 19 | 10 | 9 | 9 | फ्लोरीन |
| 16 | 32 | 16 | 16 | 16 | सल्फर |
| 12 | 24 | 12 | 12 | 12 | मैग्नीशियम |
| 1 | 2 | 1 | 1 | ड्यूटीरियम | |
| 1 | 1 | 0 | 1 | 0 | हाइड्रोजन |